インスリン受容体発現の多い少ないがどんな病態を生みだしているのか?
インスリンの作用というと筋肉や脂肪細胞に作用してブドウ糖をとりこみ、血糖値を下げる、吸収した糖質をグリコーゲンや体脂肪に換える、という機能だけが注目されています。
でも、ほかの作用についても考えた方がいいんじゃないの?
ということで、
インスリン受容体の発現についてBioGPSでかくにん!してみたところ、発現臓器ランキングでは
1位 副腎、2位 胎盤、3位 卵巣
となったというお話が前回の記事でした。
インスリンが強く作用する意外な臓器 受容体の発現を見ると・・・
http://xn--oqqx32i2ck.com/review/cat29/post_268.html
さて、その続きであります。
とりあえずは前の話の続きですね。
インスリン受容体の発現が高い三つの臓器に続いて、四番目に高いのは膵臓および膵島。
4.膵臓 pancreas
膵臓の島 pancreas islet
こちらはインスリンと拮抗する作用のグルカゴンを出すα細胞もあるし、インスリンを出すβ細胞もあります。
それらの細胞の機能にインスリンのフィードバックが働くのが当然ですね。
(インスリンがたくさん分泌されているかどうかを感知して新たに、あるいはさらに出すか、出すのをやめるかを決めるわけですから。)
だから膵臓に受容体の発現量が高くても何の不思議もないです。
一つ気になったのは、これだけ受容体の発現が高いというのであれば、この臓器自身もインスリン刺激を繰り返し受けることが疲弊の根本的な問題になりはしないかということですね。
「インスリンの早期導入は膵臓を休ませるので臓器保護効果がある」
というお話、ほんとうにそうなのかどうか、ちょっと気になりました。
まあ、しかしこの臓器でのインスリン受容体の発現が高いのは別に意外ではありませんでした。
そして五番目に発現が高いのが胎児の甲状腺(大人の甲状腺では高くない)
5.胎児の甲状腺 Fetal Thyroid
(これ、機能と高発現の意味について考察したけど、説明が糞長い上に結論があいまいなので、投稿前の編集ですべてカットしました。)
この後に、
6.腎臓
7.子宮体部
8.副腎髄質
9.CD105+血管内皮
10.CD34+(血液幹細胞と末梢血管内皮細胞)
などと続くわけです。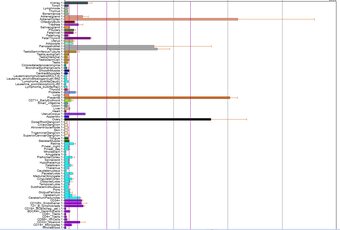
By User Meiquer - English wikipedia, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=1498599
・・・なんか変な感じがします。
どうして筋肉、脂肪、肝臓などがインスリン受容体発現の上位にまったく出てこないのでしょうか?
そう思って、別の日にBioGPSを見てみると、あれれ?こんなんでました。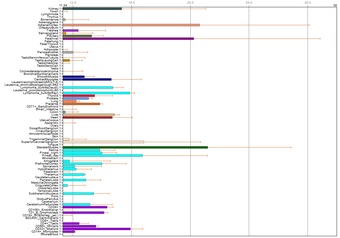
前に見たのと全然違うじゃないですか!?
今回は発現ランキングを付けると
筋肉
副腎
胎児肝臓
神経節
松果体
腎臓
ミエロイド系白血球
肝臓
心臓
心筋細胞
CD34+(血液幹細胞と末梢血管内皮細胞)
胎盤
NK細胞
下垂体
甲状腺
という感じの順番です。
前の図で2位だった胎盤は12位ですが、卵巣は圏外です。
なんじゃこれ~?
ですよね(笑)。
これは、実はプローブの違いによります。
プローブというのは(詳しい説明はカット)、インスリン受容体の特定の遺伝子配列を認識できるラベルです。
BioGPSのインスリン受容体のページを見ると、プローブは二種類使われていました。
http://biogps.org/#goto=genereport&id=3643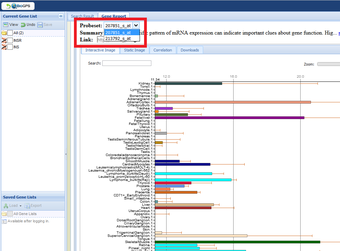
プローブ213792_s_atで調べると副腎、胎盤、卵巣の順番に並び、
プローブ207851_s_atで調べると筋肉、副腎、胎児肝臓の順番に並びます。
これ、全く違う位置の遺伝子配列を認識するものかと思って調べたのですが、どちらも「Fibronectin, type III-like fold|Protein kinase-like domain」であり、おそらく近くの部位の遺伝子配列を認識するプローブです。
(RefDICというサイトにデータが並んでいます。)
ではなぜこんなに臓器別の発現量の順番が異なるのか?
インスリン受容体にはα鎖のC末端のアミノ酸配列が12個ほど、あるものとないものがあります。
短いものがIR-A、長い物がIR-Bです。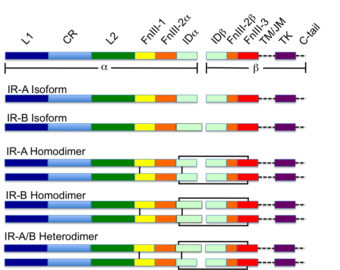
By Fletcher01 - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=18479260
しかしこのアミノ酸配列の相違に対応する部分はFibronectin, type III-like foldではなくてIDα領域なので、このプローブの違いには直接対応しないはずです。
とはいうものの、そのアミノ酸配列の相違に対応するmRNAの遺伝子配列の有無によってプローブへの結合のしやすさが影響を受ける可能性はあります。
もしも二つのプローブがそれぞれIR-AとIR-Bを認識しやすかったとしたら?
その場合は例えば
二つのプローブのどちらでもインスリン受容体の発現が高い副腎ではIR-AとIR-Bがどちらもそこそこ発現していて、
プローブ213792_s_atが認識しやすいIR-Aは卵巣や胎盤で発現量が高くて、筋肉ではあまり発現していなくて、
プローブ207851_s_atが認識しやすいIR-Bは筋肉で発現量が高いが、卵巣ではあまり発現していない。
などの状況が起こりえます。
これ、仮定の話なので最終的な確認は必要です。
ですが、臓器によって異なるタイプのインスリン受容体が発現しやすいということはありえますね。
ちなみに、IR-Aから入るシグナルはIR-Bから入るシグナルよりも1.5倍ほど強いという話はありますが、けた違いに異なるわけではありません。
そうすると、どちらが出ているのかでのシグナルの入りやすさの差はあまりないと考えることができるでしょう。
んで、最終的に何が言えるかというと
1.両方のプローブで発現の上位に入ってくる副腎、胎盤、血管内皮などはインスリンの作用がほぼまちがいなく強く入る臓器でしょう。
2.片方のプローブで発現上位の卵巣と筋肉はそれぞれ異なる受容体を介してインスリンシグナルが入るかもしれないが、強く入るのは間違いないでしょう。
3.両方のプローブのどちらでも発現が低いとされる臓器はインスリンの影響を直接受けることはほぼないでしょう。
ということですね。
こうして見た時に、糖尿病との絡みですごく注目すべきは末梢血管内皮細胞(CD34+あるいはCD105+細胞)でのインスリン受容体が常に高いことかもしれません。
<血管内皮>
糖尿病というのは血管がやられる病気です。
糖尿病の合併症といわれる糖尿病性腎症、糖尿病性網膜症、糖尿病性末梢神経障害などはこれらすべて、毛細血管がやられる病気です。
これまで、高血糖や、それに起因する血管内皮のAGE化が毛細血管を傷めるのでそう言う合併症が出やすいと考えられてきました。
でも、糖尿病の患者さんの病態を考えると
1.高血糖が誘発する食後の追加分泌インスリン刺激が慢性的に毛細血管の血管内皮細胞に入っている。
2.血糖を下げるために投与するインスリン製剤が投与するごとに毛細血管の血管内皮細胞を繰り返し刺激している。
という状況は起こっていますよね。
末梢神経障害を引き起こしているのが、実は高血糖なのではなくて、インスリンの過剰な刺激がこれらの末梢血管内皮細胞(CD34+あるいはCD105+細胞)に繰り返し入ることが問題なのではないか?
毛細血管内皮細胞のインスリン受容体の発現量がけっこう高いことを考えると、そのように考えることもできます。
もちろんこれは、あさひ内科クリニックの新井圭輔先生がおっしゃっていることを念頭に置いての話の展開ですよ。
「糖尿病の合併症と相関するのは血糖値ではなくてインスリン投与量である。」
そんな観察結果を支持するエビデンスとなりうるデータということになります。
と、いうことで、インスリン受容体の発現プロファイルをネタにいろいろと考えてみました。
私的にはけっこうおもしろかったのですが、どうでしょうか?
コメントお待ちしております。(^◇^)






カルピンチョ先生
流石!! インスリンの受容体とその遺伝子発現にまでに及んで記述されたのを見たのは初めてでした。ありがとうございます。
>妊娠初期の胎児の脳発達がもっとも重要な時期に胎盤が十分な量のケトン体を産生できるようにしているからではないか?
私は以前どこかのブログで次のようなコメントしましたが、全く相手にされませんでした。(笑)
「ツワリとは内因性自己ファスティング現象・・・ケトン体産生・オートファジー亢進(体内リセット)・・・」という内容でした。
今回の記事で援護射撃をいただいたようで、非常に嬉しいです。
>末梢神経障害を引き起こしているのが、実は高血糖なのではなくて、インスリンの過剰な刺激がこれらの末梢血管内皮細胞(CD34+あるいはCD105+細胞)に繰り返し入ることが問題なのではないか?
これを最初に主張したのは、私の記憶では池先生だったと思います。
>Yamamoto_maさん
記事のコンセプトが喜んでいただけて良かったです。
硬すぎてとっつきにくいかなと思っていたので(いつものことですがw)良かった。
> 私は以前どこかのブログで次のようなコメントしましたが、全く相手にされませんでした。(笑) 「ツワリとは内因性自己ファスティング現象・・・ケトン体産生・オートファジー亢進(体内リセット)・・・」という内容でした。
・・・そうですね、私の産婦人科医としての経験から、といってもおそらく1000人ちょっとくらいの分娩とその数倍の妊娠管理にしか関わっていないのですが、
つわりってすごく個人差が激しいのですよね。
一律に全員に起こるわけではありません。
ない人は全く何もなく、最初から最後まで気持ちよく妊娠継続されています。
どうしてこんなに差が激しいのかなと思っていたのですけれども、
ある程度のケトン濃度が保たれている妊婦さんではつわりが激しくなくてすむのかな、
と考えてしまいますね。
同じ量の糖質を食べていても、胎盤が頑張ってケトン体をどんどん作っている妊婦さんの場合はケトン体が足りているからつわりになる必要がないのかなと。
胎盤の脂質代謝機能があまり強く無いときに、食事から糖質を入れないようにつわりがひどくなるのかな、なんて。
妊娠前から糖質制限している人のつわりについて観察する機会がこれから増えてくるでしょうから、そうなったらまた答えが見えてくるかもしれないですね。
>インスリンの過剰な刺激がこれらの末梢血管内皮細胞(CD34+あるいはCD105+細胞)に繰り返し入ることが問題なのではないか? これを最初に主張したのは、私の記憶では池先生だったと思います。
・・・そうなんですね。
検索してみると内皮細胞とインスリンの関係については1990年代から論文がけっこうありますね。
もっとさかのぼってあるのかもです、むかしの論文をまた掘ってみなくては(;^ω^)
カルピンチョ先生
おっと失礼!
池先生とは釜池豊秋先生のことです。なぜか釜が抜けていました。失礼しました。
コメントのコメントありがとうございます。
話が変わって申し訳ありませんが、いつだったか「ためしてガッテン」でアルツハイマー病とインスリンの関係で話題になりましたね。
インスリン分解酵素(IDE・ネプリライシン)はインスリンとアミロイドβの分解とで競合しているので、なるだけ炭水化物の摂取を控えましょう、といった内容で締めくくっていたように記憶していました。
ところがですね、某マッチポンプ学会ではこのインスリン分解酵素の働きを阻害する物質の研究・開発がメイヨークリニック(だったと思う)で進められているということで、大変期待しているとのコメントがありました。オイオイ違うだろー!
最近のことですが、悪名高き「ためしてガッテン」で糖尿病に睡眠薬を・・・で大騒ぎになって同番組でかなりの時間を割いて謝罪がありました。
厳密には「糖尿病に」ではなく「糖尿病合併症に」と置き換えればなるほどこれもありかも・・とおもいました。
IDEは睡眠中に活性化することが知られていますので・・・
矛盾があればご指摘くださいませ。
すごい
「新井先生」と「カルピンチョ先生」お二人へ
敬意を込めて 次の言葉を贈ります
<真実は、それを理解する人のところしか
近づかない>
すごいです
無名さん
ぼくは研究オタクだったのでこういうこと考えるのは好きです。ただ、実践がともなっていないので、臨床に戻って2年目ですが、これから徐々に実践につなげて行けたらと考えています。
Yamamoto_maさん
> 最近のことですが、悪名高き「ためしてガッテン」で糖尿病に睡眠薬を・・・で大騒ぎになって同番組でかなりの時間を割いて謝罪がありました。 厳密には「糖尿病に」ではなく「糖尿病合併症に」と置き換えればなるほどこれもありかも・・とおもいました。 IDEは睡眠中に活性化することが知られていますので・・・ 矛盾があればご指摘くださいませ。
・・・なるほど、過剰なインスリンおよびアミロイドβを、しっかり寝ることで分解しやすくなるというわけですね。
IDEが推測の通りだとすると矛盾はないように思えます。
持続型のインスリンを投与している人でも、しっかり寝ることが、寝る前の過剰なインスリン投与で引き起こされるソモジー効果の発生を防ぐと考えることもできますね。
もちろん、某学会の先生がたの危惧通りに、効きが悪くなるということも理論上は起こりえます。
あ、そうか、そしたらメイヨ―クリニックはIDEの分解阻害薬なんか薬開発しないで、既存の薬を組み合わせて睡眠不足になる投薬で、寝る前に打つ持続型インスリンの効果を強めることができますね。
↑
どうどうめぐりww