糖尿病性ケトアシドーシスと糖質制限によるケトーシスの違い
~ケトン体高値はそれだけで本当に危険なのか?~
糖質制限を続けていく人の血液中ではケトン体の濃度が上がり、ブドウ糖の代わりのエネルギーとして使われます。
一方、血中のケトン体が高くなるのは危険で良く無いことだという考え方があります。
その考えが特に強いのは糖尿病専門医の先生たちで、糖質制限賛成派の山田悟先生でさえも、絶対にケトーシスにならない範囲での糖質制限のロカボを勧めています。
糖尿病専門医が恐れおののく血中ケトン体上昇(基準値とされるのは125~130μmol以下です)。
その病的な意味について私なりに考察してみます。
<ケトン体が高値になる三つのシチュエーション>
(6月4日にケトン体値について訂正・追加記載しました。)
1.糖尿病性ケトアシドーシス(Diabetic Keto-Acidocis; DKA)という病態があります。
主に1型糖尿病患者さんが何らかのトラブルに見舞われたときに発生する命にかかわるアシドーシスです。
このときには血液中のブドウ糖およびケトン体の値が大きく上昇しています。
ケトン体は構造式上は酸なので、溶液中で濃度が上昇するとその溶液は酸性になると考えられています。
したがって、ケトン体の濃度が高くなることがアシドーシスを生み出している原因であると考えられています。
このときの血中ケトン体の濃度は2000~数万μmol/L以上です。
(ここですが、いくつかの症例報告から持ってきたものの、規定した数値がありましたので訂正します。英語版のWikipediaのKetosisの解説の中にありました。 https://en.wikipedia.org/wiki/Ketosis This table shows the concentrations typically seen under different conditions. ケトアシドーシスの場合、15~25mmol、つまり1万5千から2万5千μmol/Lが典型的な数値です。 2017年6月4日訂正 このかっこ内に文章追加)
症状としては口渇、全身倦怠感、吐き気と嘔吐、激しい腹痛、努力性の大きな呼吸、意識不明などです。
緊急輸液やインスリン投与して治療しないと、死に至ることがあります。
2.ケトン食という治療食があります。
脳で血糖をうまくとりこめない、あるいは血糖を取りこむと異常なスパイクが発生することによりてんかん発作を起こす患者さんの治療食です。
食事内容は釜池式断糖食(糖質は一日20g以下)が基本であり譲っても江部式(糖質は一日60g以下)までです。
しかも肝臓での糖新生による血糖値上昇も必要最低限に絞りこむため、摂取カロリーのほとんどは脂質が占めます。
さらに、効率よくケトン体濃度を高めるために中鎖脂肪酸を積極的に摂取させます。
このときの血中ケトン体の濃度は4000~1万μmol/L、あるいはそれ以上です。
(Wikipediaの記載によれば、ケトン食で誘導されるのは、0.5~3mmol、つまり500から3千μmol/Lが典型的な値です。 2017年6月4日訂正 このかっこ内に文章追加 ・・・症例報告ではもっと高い人います。)
このときにDKAのようなアシドーシス症状は発生しません。
3.糖質制限食でもケトン体が増えます。
釜池式断糖食などに見られる糖質摂取を極力抑える(一食当たり5g以下の)食事方法があります。
こちらは糖尿病などの生活習慣病やその予備群の人はもちろん、健康な人も健康維持のために実践しています。
簡易ケトン体測定器の普及により、この方たちがケトン体値を頻繁に測るようになりました。
このときの血中ケトン体濃度は5000μmol/L以上の人がざらにいますし、簡易測定器では測定不能なほど高い人もいます。
(Wikipediaの記載によれば、糖質制限で誘導されるのも、0.5~3mmol、つまり500から3千μmol/Lが典型的な値です。 2017年6月4日訂正 このかっこ内に文章追加 ・・・簡易測定器による自己申告ではもっと高い人います。)
何の症状もなく元気です、DKAのようなアシドーシス症状は発生しません。
(ちなみに飢餓時のケトン体濃度はWikipediaの記載によれば3~6mmol、つまり3千から6千μmol/Lが典型的な値です。このときにもインスリン基礎分泌があればDKAのようなアシドーシス症状は発生しません。 2017年6月4日 このかっこ内に文章追加)
さて、この三つのシチュエーションでのケトン体の濃度はかぶっています、ほぼ同等の範囲にあるといっても差し支えないでしょう。
(すみません、かぶっていませんね。(;^ω^) いずれも一般的な検査の「基準値」は超えているものの、かぶっていないようです。以下の記載によればです。https://en.wikipedia.org/wiki/Ketosis This table shows the concentrations typically seen under different conditions.)
でも、なぜだか、
糖尿病性ケトアシドーシス(DKA)のときにだけ
「ケトン体の濃度が高いせいで、命にかかわるようなアシドーシスになる」
だからケトン体は危険だというのですね。
・・・なんかすごく変だと思いませんか?
ケトン体の濃度はいずれのシチュエーションでもとても高いのに、DKAのときだけケトン体が悪者にされる。
なんだかさっぱり、理屈に合わないですよね。
<糖尿病性ケトアシドーシスはどういうときに起こるのか?>
糖尿病性ケトアシドーシス(DKA)とはそもそもどういうときに発生するのでしょうか?
基本的には1型糖尿病の人、つまり「膵臓がインスリンを全く作れなくなっている人」が「何らかのトラブルに見舞われたとき」にDKAは発生します。
トラブルというのは以下のようなものです。
1.毎日打っている基礎分泌インスリン相当のインスリン剤を注射しなかった
2.インフルエンザやノロウイルスにやられて病気になった
3.大きなけがや脱水状態に陥った
http://xn--oqqx32i2ck.com/review/cat29/post_153.html
このような状況に陥っていることを指します。
1番目のインスリンの打ち忘れ、あるいはうっかり切らしてしまってインスリンを打てなかった時には、患者さんの体にはインスリンが全くない状態が発生します。
2番目の感染症が発生したときには、病原体をやっつけるために免疫細胞が炎症性サイトカインと呼ばれる物質をたくさん作り出しますが、これらのサイトカインはインスリンの作用を阻害してしまうことが報告されています。
3番目の大きなけがや脱水状態に陥った時は緊急事態ですから、細胞は急いでエネルギーを作り出す必要が出てきます。(これは2番目の時も同じですね。)
体からインスリンが完全になくなってしまったとき、脂肪細胞や筋肉細胞などのインスリン依存性に血糖を取りこむ細胞はブドウ糖をまったくとりこめなくなります(ブドウ糖とりこみ分子のGLUT4が発現されなくなるためです)。
これが問題を引き起こすのですね。
どういうことになっているのでしょうか?
次からは私なりの考察です、間違っていると思ったら"科学的な"ご批判をいただければ嬉しいです。
非論理的な、感情的な、あるいは"知ったかぶりなのにこちらの書いている内容を実は理解できていなくて的外れな"批判は黙殺しますのでよろしくです。
普通の感想はもちろん歓迎です。
まずは基本的なことの確認
<ケトン体エンジンはミトコンドリアで回るが、最初にブドウ糖が必要>
糖質を食べなくてもよい理由については別のサイトの記事で書きました。
食事からブドウ糖を摂取しなくても必要なブドウ糖の量(一日150g)は糖新生でカバーされるので大丈夫です。
それに、体の細胞の多くはケトン体でも動くことのできるハイブリッドエンジンの細胞だから、糖質摂取ゼロでもエネルギー的にまったく問題なしです。
糖質制限でなぜ痩せるのか
http://healthpress.jp/2017/05/post-2998.html
さらに、糖質制限して追加インスリンがほとんど分泌されないと肝臓での脂肪酸の切り出しが亢進し、ケトン体がどんどん産生され始めます。
このケトン体は脂肪酸(ケトン体)エンジンを持つ細胞群のエネルギーとして使われるようになります。
数字の上での理論では、上記の内容は間違いありません。
ですが、ハイブリッドシステムでケトン体エンジンが回るために多くの細胞はほんのわずかのブドウ糖を必要とするとも考えられています。
どういうことでしょうか?
ケトン体エンジンとは、ミトコンドリア内部のTCA回路が回転している状態を指します。
ケトン体をエネルギーとしてこの回路に組み込むというわけですが、回路が回り出すためには起点となる物質であるクエン酸が必要です。
(TCA回路の別名がクエン酸回路であることは中学校の理科でならいましたよね。)
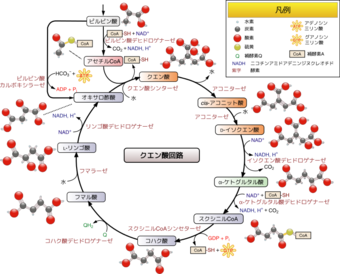
クエン酸回路の図 Wikipediaより
By Source file: Narayanese, WikiUserPedia, YassineMrabet, TotoBaggins. This file: Calvero - Image:Citric_acid_cycle_with_aconitate_2.svg, CC 表示-継承 3.0, https://commons.wikimedia.org/w/index.php?curid=15821364
通常、クエン酸はオキサロ酢酸とアセチルCoAを原料として作られます。
このオキサロ酢酸およびアセチルCoAの原料となるのはピルビン酸で、これはブドウ糖からできます。
(脂肪酸からも作られますが、ブドウ糖から作り出す方が簡単です(後述)。)
つまり多くの場合、TCA回路がすぐに回り出すためには、ほんのちょっとのブドウ糖(グルコース)があった方がよいのです。
このほんのちょっとのブドウ糖ですが、もちろん食事からとる必要はありません。
健常な人であれば主に肝臓での糖新生により自分の体内でブドウ糖を作り出すことができます。
また、基礎分泌インスリンが出ていれば(追加分泌インスリンは出なくても)、筋肉や脂肪などの全身の細胞が糖質を利用するのに必要なインスリン量はこと足ります。
ここまで、よいでしょうか?
<糖尿病性ケトアシドーシスの発生メカニズム(通説)>
糖尿病性ケトアシドーシスが発生する症例の多くでは、体内に基礎分泌インスリンが全くない状態であると考えられます。
筋肉細胞や脂肪細胞がブドウ糖をとりこむ際にはGLUT4というブドウ糖トランスポーターを細胞表面に出す必要があります。
このGLUT4を細胞表面に発現させる役割を持つのがインスリンです。
つまり、何らかのトラブルにより基礎分泌インスリンがなくなってしまった糖尿病患者での脂肪細胞や筋肉細胞表面にはGLUT4の発現がほとんどなくなり、ブドウ糖を利用できません。
このために筋肉細胞や脂肪細胞のミトコンドリアのTCA回路はクエン酸が準備できずに動きだすことができません。
その一方で低インスリン(インスリンゼロ)に対応して肝臓は脂肪酸を処理してケトン体を作り出し、血流に乗せて筋肉や脂肪へと送り届けます。
でも、ケトン体は筋肉細胞や脂肪細胞に届いてもTCA回路が回っていないので、うまく消費されないままで余ってしまいます。
仕方ないから血中にどんどんたまります。
肝臓の方はあいかわらずインスリンシグナルがないので、「ブドウ糖がないからインスリンシグナルが入らないんだ、代わりのエネルギーを頑張って作らなきゃ!」とばかりにケトン体をどんどん作り続けます。
インスリンゼロでは筋肉や脂肪はケトン体を使えない。
インスリンゼロでは肝臓はケトン体を作り続けるのを止められない。
それで血中のケトン体濃度がどんどん上がるのですね。
さて、本題です、長いよ。(^◇^)
<糖尿病性ケトアシドーシスの真実(仮説)>
で、この余ったケトン体が本当にアシドーシスの状態を作り出しているのか?
ここが、どうしても疑問ですよね。
最初に提示した通りに、
ケトン食を食べている子供や、きびしい糖質制限をしている人たち
血中ケトン体濃度はむちゃくちゃ高いです。
でも、アシドーシスにはならない。
・・・ひょっとして、糖尿病性ケトアシドーシスになるときにアシドーシス状態を引き起こしている犯人は他にいると考えられないでしょうか?
はい、犯人候補(というか、直接手を下さないフィクサー候補)がいます。
嫌気性解糖で生み出された乳酸です。
インスリンが完全に枯渇した状態、脱水や感染症で非常事態に陥った細胞群はブドウ糖も取りこめないし、ミトコンドリアのTCA回路も回りません。
でも、それでも生き延びなければなりません、ミトコンドリアのTCA回路が回り始めるのを待っているわけにはいかないのです。
ではどうするか?
ミトコンドリアを使わずにエネルギー産生(嫌気性解糖)します。
筋肉細胞内には実はブドウ糖の蓄えがあります。
グリコーゲンです。
グリコーゲンはブドウ糖が連なってできたもので、非常用のブドウ糖として筋肉に特にたくさん貯蔵されています。
非常事態に陥った筋肉細胞や脂肪細胞は蓄えてあったグリコーゲンを分解し、グルコース(ブドウ糖)に換えてエネルギーとして利用します。
このときは非常事態なので、非常に早くエネルギーをとり出すことのできる解糖経路を使います。
嫌気性解糖といって、酸素を使わずにエネルギーを生みだすことができます。
しかも、酸素を使う方法(ミトコンドリアのTCA回路を用いた方法)である好気性解糖の1000倍のスピードでエネルギーをとり出すことができます。
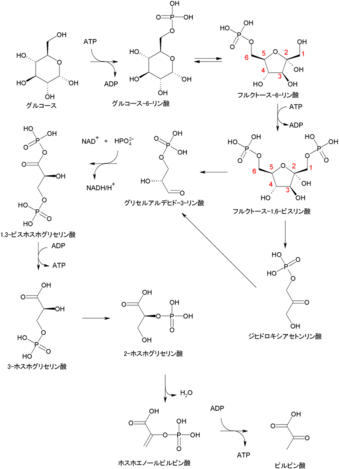
解糖経路の図
パブリック・ドメイン, https://ja.wikipedia.org/w/index.php?curid=1269666
何らかの非常事態(インスリンの枯渇、感染症、脱水など)で筋肉細胞などが一斉に嫌気性解糖を使って急いでエネルギーを得たとします。
このときに、エネルギーをとり出されたグルコース(ブドウ糖)はピルビン酸に換わるのですが、できたピルビン酸は嫌気的条件では速やかに乳酸に変わります。
細胞内に乳酸がばんばんたまるのです。
乳酸は酸性の物質で、血液を酸性に変えてアシドーシスの状態を生み出すことができます。
これが犯人として怪しいです。
でも、おそらく、直接的な犯人ではありません。
***以下からは私の仮説です***
人間の体内のpHというのは7.35~7.45の間で厳密に管理されています。
この厳密な管理に必要なのが血液や体液に含まれているCO2やHCO3-というバッファー機能を持つものたちです。
非常事態の筋肉組織で嫌気性解糖が一斉に起こるとどうなるか?
筋肉細胞内の嫌気性解糖で生成された乳酸は、荷電があって細胞膜を通りにくいので直ちに血液中に出てくることはありません。
でも、そのまま放置していると細胞の中がやばいので、筋肉組織や脂肪組織の中に蓄えてあった重炭酸イオン(HCO3-)によるバッファー機能でpHが補正されます。
大量に蓄積された乳酸のH+が、筋肉組織の重炭酸イオンを消費しまくります。
インスリンゼロの状態がしばらく続くと、筋肉組織などに蓄えられていたはずのこのバッファー機能が(一時的にせよ)失われてしまうのです。
もちろん、HCO3-の最大の供給源は腎臓の近位尿細管であり、補正することができるのですが、糖尿病性ケトアシドーシスの発生するような病的な状態ではこれが間に合わない(もしくは腎機能障害そのものも原因のひとつとなりうる)。
このために、本来であればバッファー機能で簡単に代償できるはずのケトン体の「酸性」を抑えきれなくなります。
その状態でケトン体値が高くなると、アシドーシスになってしまうのです。
つまり、糖尿病性ケトアシドーシスの病態を引き起こしているのは、
「嫌気性解糖で生み出された細胞内の乳酸が組織内のバッファーを消費してしまった状況下でケトン体が増えたために補正できずに発生するアシドーシス」
であるのかもしれないのです。
逆に言うと、バッファーシステムが機能していればケトン体は怖くありません。
基礎分泌インスリンにより筋肉細胞などでGLUT4が十分に発現している人では、ベースラインの血中ブドウ糖を利用できていて、ミトコンドリアのTCA回路も機能しているので
ケトン体を使えているし、かなりケトン体値が高くなってもpHは低下しないのです。
少なくとも基礎分泌インスリンの出ている健常人において、ケトン体過剰は恐れるものではない
エネルギー源として安全に利用するバッファーシステムが体には備わっている
と考えられるわけです。
***仮説終わり***
補足です。
<検査結果で見えているものと真実のかい離(仮説に基づく)>
上に述べたように、糖尿病性ケトアシドーシスの原因を引き起こしている最初の要因が、インスリンゼロの非常事態に対応するために筋肉組織内で発生している嫌気性解糖による乳酸の蓄積だとします。
しかし、筋肉組織内で上昇している乳酸は膜を通りにくいので血液を調べても良く見えません。
さらに、筋肉組織内の乳酸は組織内の重炭酸イオンのバッファー機能で処理されるのでよけいにその存在がわかりにくくなります。
つまり、筋肉組織で乳酸が上がってバッファー機能を使い倒してしまうことが問題なのですが、検査で引っかかるのは筋肉組織が使えないで持て余すケトン体値の上昇ばかり。
アシドーシスを疑って緊急検査してみたら、ケトン体値は高い、乳酸はそれほど高くない、ということで
「ケトアシドーシスだ!悪いケトン体め!」
となっているという可能性があるわけです。
・・・ということで、
糖質制限をしてケトン体値がばんばん上がることを健常人が怖がる必要は何もない
(糖尿病性ケトアシドーシスは筋肉組織での乳酸の蓄積とTCA回路の機能停止が主な原因)
というのが私の結論です。
長い時間をかけて書いたわりには、まとめて理解すれば短い考察なのですが、
どう考えられますか?






>乳酸は酸性の物質で、血液を酸性に変えてアシドーシスの状態を生み出すことができます。
これが犯人として怪しいです。
でも、おそらく、直接的な犯人ではありません。
この仮説、賛成しま~~す!!
これを逆手にとってがん治療に使う、というのが福田先生の最近の記事で述べられていました。
(がん組織は酸性化されており、がん細胞はアルカリ化されているのを根拠にしての考察です。)
「541)乳酸脱水素酵素A(LDHA)と鶏血藤と五倍子とジクロフェナク」
http://blog.goo.ne.jp/kfukuda_ginzaclinic/e/e31a2a3e8a16f18f3c3fc491f9ae46ab
一つ質問ですが・・・
「肝臓でケトン体を産生し、肝臓自身はケトン体を利用しない」というのをよく目にしますが、理由が分かりません。
何故でしょう??
カルピンチョ先生
御無沙汰しております。たがしゅうです。
科学的な視点で流石の考察力ですね。
しかも検査で検出できない見えない部分にも考察の手を届かせている所に先生の凄さを感じます。
今後も先生ならではのブログ記事を楽しみにしております。
「過剰乳酸がバッファー機能を停止させてしまう」という先生の仮説が正しいとして、真っ先に思い浮かぶのは「乳酸アシドーシス」の事です。
メトホルミンの副作用として有名ですが、私は以前、これは虚血や低酸素状態において起こりやすいのではないかと考察しました(http://tagashuu.blog.fc2.com/blog-entry-320.html)。
またメトホルミンの作用の主たる起点はAMPK(AMP-activated protein kinase)であり、これは運動による誘導される酵素でもあり、メトホルミンは疑似運動薬という考えを持っています。
一方で長時間のマラソンランナーらが走り続ける中で、エネルギー切れになって動けなくなるという「ハンガーノック」と呼ばれる状態に陥ることがあると言われています。
筋肉の過剰使用でまさに乳酸がたまり続けて、これはメトホルミンの過剰使用にも通じるわけですが、動けなくなっているのは、もしかして乳酸アシドーシス、もっと言えばもしその時にケトン体を測ったらケトン体高値でケトアシドーシスの状態でもあるのかもしれないと思いました。
非常に合点がいく仮説だと思います。
>Yamamoto_maさん
コメントありがとうございます。
> この仮説、賛成しま~~す!! これを逆手にとってがん治療に使う、というのが福田先生の最近の記事で述べられていました。
・・・ご紹介ありがとうございます。
記事を読んでみましたが、糖尿病性ケトアシドーシスのメカニズムの話ではないですよね??
どのあたりが逆手に取っているのかがよくわからなかったのですが(;^ω^)
でも興味深い記事でした。
極論すればボルタレンで糖尿病性ケトアシドーシスが予防できるという話、ということですかねえ。
> 一つ質問ですが・・・ 「肝臓でケトン体を産生し、肝臓自身はケトン体を利用しない」というのをよく目にしますが、理由が分かりません。 何故でしょう??
・・・これ、いろんなところに書かれているのは、「肝臓自身がケトン体を利用しちゃうと作る咲きから使っちゃって、ほかの臓器にたくさん送り出せないからだろう。」となっておりますね。
リーズナブルに聞こえる説明だと思いますが、根拠となる文献は知りません。
同様な論理展開で、「赤血球に核がなくて嫌気性解糖系しか使えないのは自分自身で酸素を使ってしまったらほかの臓器に酸素を十分渡せないから。」という話があって
こちらは鳥類、爬虫類、両生類が有核赤血球であることとの整合性が取れない説明です。
ですから、もう少し深く考えてみる必要があるのかもしれませんね、
なんで肝臓はケトン体を利用できないのかに関しても、ほかの理由があるのかもしれない。
>たがしゅう先生
ごぶさたしてます、いつぞやTボーンステーキをご一緒して以来ですね。
> 「過剰乳酸がバッファー機能を停止させてしまう」という先生の仮説が正しいとして、真っ先に思い浮かぶのは「乳酸アシドーシス」の事です。 メトホルミンの副作用として有名ですが、私は以前、これは虚血や低酸素状態において起こりやすいのではないかと考察しました(http://tagashuu.blog.fc2.com/blog-entry-320.html)。
・・・読ませていただきました、なるほど。
メトホルミンは疑似運動させてるようなものである!
わかりやすいです。
実は私の今回の「過剰乳酸がバッファー機能を停止させてしまう」かつ、「乳酸が血液中にすぐに出てこないのでそれが見えない」という考え方も運動時のメカニズムに対するコンセプトから拝借しました。
すなわち、
運動時にはPaCO2が上昇するのですが、それもまさしく「運動時に筋肉内に乳酸が蓄積し、乳酸のH+がHCO3-を消費してCO2が産生され、膜を通りやすいCO2が血中に出てくるが、荷電を持つ乳酸は膜を通りにくいので血液中では見えにくい」という考え方によります。
運動で組織や静脈血のPco2が上昇するメカニズム:
http://www.acute-care.jp/ja-jp/document/bloodgas-museum/category01/anaerobic_meta
その説明を思いだしたので、逆にHCO3-不足を思いついたわけです。
>エネルギー切れになって動けなくなるという「ハンガーノック」と呼ばれる状態に陥ることがあると言われています。 筋肉の過剰使用でまさに乳酸がたまり続けて、これはメトホルミンの過剰使用にも通じるわけですが、動けなくなっているのは、もしかして乳酸アシドーシス、もっと言えばもしその時にケトン体を測ったらケトン体高値でケトアシドーシスの状態でもあるのかもしれないと思いました。
・・・なるほど、ハンガーノックもそのときの血液を調べたら軽いアシドーシスになっているのかもしれませんね、面白いです(といったらハンガーノックで困っているアスリートから怒られるかもですが)。
メトホルミンの作用で乳酸アシドーシスにまでなっちゃう人の場合はYamamoto_maさんが紹介された福田先生の記事に照らし合わせて考えると、ほかの人とLDHの産生量が異なっているのかもしれないですね。
いろいろまた考えさせられました、ありがとうございました。
カルピンチョ先生
はじめまして みんと申します。
仕事中の眠気がひどくて耐えられず、試しに二ヶ月平日の夜だけ主食を納豆か豆腐にかえて少しましになったので、思い切って4日前から糖質制限を始めました。カルピンチョ先生の教えを読んだその次の食事から(^_^)ノ
コレステロールが18歳で初測定から高く、実父含め父方が血管系で多く早世しているので、血管への負荷が軽くなればと少し期待しつつ。
まだ計算できる十分な知識がないけど高いのはコレステロールだけなので、今後調べながらいい感じの分量と楽しみのバランスを探せば良いと、とりあえず見よう見まねでトライ…
…そうしてみたら、次の朝から、寝起きが全然違います!
夜が遅い日でも、朝に30分以上散歩しても、早起きしても、仕事中に眠気、きません!!筋肉量も増やして、健康な体を作りたいと思います(^^)v
今回の記事の内容はちょっと難しかったのですが、重症な病気のない人なら、厳しい糖質制限をしたって、体がうまーいこと調整してくれるから、気にせず糖質制限しても大丈夫ってことですね。安心しました。
カルピンチョ先生
>記事を読んでみましたが、糖尿病性ケトアシドーシスのメカニズムの話ではないですよね??
すみません。 確かにこの記事では「逆手に取って」デンデン・・おっと、云々は見えませんね。
で、実は私の紹介した記事はこの記事の前の記事の延長線上の内容でした。失礼しました。
前記事・・・2017年05月09日
「540)がん細胞内を酸性化すると増殖が抑制され細胞死が誘導される」
http://blog.goo.ne.jp/kfukuda_ginzaclinic/e/b8226560d6717ec7fd57eca02983fa82
>なんで肝臓はケトン体を利用できないのかに関しても、ほかの理由があるのかもしれない。
肝臓内の酵素の内容に他の臓器と違うのかも?と調べましたが見あたりませんでした。
因みに私の近々(5月17日)のケトン体測定値を記しておきます。
・総ケトン体-----5020μM/L
・アセト酢酸----- 610μM/L
・3ヒドロキシ酪酸----4410μM/L
それでいて血糖値は99mg/dl も有り、ハイブリット化されておりました??。(なんでだろ?)
ついでに脂肪酸4分画(年二回保険適応)も測定してもらいました。
・ジホモɤリノレン酸-----28.8μg/mL
・アラキドン酸 ----352.2μg/mL
・EPA ----210.7μg/mL
・DHA ----301.5μg/mL
・EPA/AA ----0.60・・・もっと高値が欲しい。
・インスリン -----1.2μU/mL ・・・典型的な糖尿病体質です。(笑)
久々にメトホルミン処方をお願いしましたが、「そんなもんいらね~~!!」と一蹴されちまった。
カルピンチョ先生
>肝臓内の酵素の内容に他の臓器と違うのかも?と調べましたが見あたりませんでした。
・・・有りました。
以下の記事
===========================
肝臓は、ケトン体を合成(産生)する酵素活性(HMG-CoAシンターゼ)は高いが、ケトン体を代謝(分解)する酵素(スクシニル-CoAトランスフェラーゼ)の活性が低いことが知られています。スクシニル-CoAトランスフェラーゼ(スクシニルCoA-3-オキソ酸CoAトランスフェラーゼ、succinyl-CoA:3-oxo-acid CoA-transferase:SCOT、EC-Number 2.8.3.5、thiophorase)は、ケトン体のアセト酢酸をスクシニル-CoAと反応させ、アセトアセチル-CoAとコハク酸に変換させます(スクシニル-CoAはケトン体の分解に必要です)。アセトアセチル-CoAは、更に、チオラーゼにより、2分子のアセチル-CoAに分解されます。このように、スクシニル-CoAトランスフェラーゼは、ケトン体(アセト酢酸)が、アセチル-CoAに分解(開裂)されるのに必要な酵素ですが、肝臓は、このスクシニル-CoAトランスフェラーゼを有していないので、産生したケトン体をアセチル-CoAに再分解して利用出来ません。スクシニル-CoAトランスフェラーゼは、肝臓以外の全ての組織に存在します。従って、肝臓以外の組織(脳、骨格筋、心筋、腎臓、副腎、腸など)は、ケトン体をアセチル-CoAに分解して、燃料分子として利用出来ます。
HMG-CoAシンターゼは、肝細胞のミトコンドリア内にのみ存在し、他の組織の細胞には、存在しません。ヒトでは、ケトン体を産生して血液中に放出する臓器は、肝臓だけです(反芻動物は、第1胃壁で胃内発酵で生成される酪酸をβ-ヒドロキシ酪酸に変換し、ケトン体として血中に放出します)。肝臓(HMG-CoAシンターゼを有するがスクシニル-CoAトランスフェラーゼは有しない)は、ケトン体を産生を産生し、肝臓以外の組織(HMG-CoAシンターゼを有しないがスクシニル-CoAトランスフェラーゼを有する)がケトン体をアセチル-CoAに再分解して利用します。
===========================
ただ、この記述は間違いだと思います。
>ケトン体を産生して血液中に放出する臓器は、肝臓だけです
http://hobab.fc2web.com/sub4-zesshoku.htm
>Yamamoto _maさん
はい、ほかの方へのコメントに返信してから返信しようとして止めていましたが、ご指摘の通りに、以下のサイトで詳しくかかれています。
---------------
絶食時の代謝
http://hobab.fc2web.com/sub4-zesshoku.htm
ここの注8の図の下に以下の文章があります。
肝臓は、ケトン体を合成(産生)する酵素活性(HMG-CoAシンターゼ)は高いが、ケトン体を代謝(分解)する酵素(スクシニル-CoAトランスフェラーゼ)の活性が低いことが知られています。
中略
従って、肝臓以外の組織(脳、骨格筋、心筋、腎臓、副腎、腸など)は、ケトン体をアセチル-CoAに分解して、燃料分子として利用出来ます。
---------------
で、気になったのでスクシニル-CoAトランスフェラーゼの発言についてBioGPSで確認してみたところ、遺伝子(RNA)発現で上の文章に合致するのはマウスのデータであり、ヒトのデータではほかの臓器に比べて非常に低いとまでは言えません。
マウス http://ds.biogps.org/?dataset=GSE10246&gene=67041
ヒト http://ds.biogps.org/?dataset=GSE1133&gene=5019
このように、文章の裏取りまでしてみると、この文章が丸のまま人の場合に当てはまるとは言えないかもしれません。
(胎盤でも低いところは、胎盤がもう一つのケトン体を作る器官であるとする宗田先生の仮説によく合う気もしますが)
肝臓がケトン体を利用できないメカニズムはほかにもあると考えておく方がいいのかもしれません。
>ただ、この記述は間違いだと思います。 >ケトン体を産生して血液中に放出する臓器は、肝臓だけです http://hobab.fc2web.com/sub4-zesshoku.htm
・・・そうですね、胎盤も考えなければなりませんし、ほかの組織で絶対に作らないかといわれると。
「成体において血液中に(大量に)放出する臓器は、」
という表記にすべきでしょうかね。
正確性を期すのであれば。
>みんさん
コメントありがとうございます。
返信が遅くなりましてすみません。
>思い切って4日前から糖質制限を始めました。カルピンチョ先生の教えを読んだその次の食事から(^_^)ノ
・・・ありがとうございます、GoGo!です♪
>…そうしてみたら、次の朝から、寝起きが全然違います! 夜が遅い日でも、朝に30分以上散歩しても、早起きしても、仕事中に眠気、きません!!
・・・よかったですね!いい感じで体の準備ができていたので、スーパー糖質制限の効果を感じつつ、困った問題は起きてない感じですね。
ぜひこのまま続けてください。
>今回の記事の内容はちょっと難しかったのですが、重症な病気のない人なら、厳しい糖質制限をしたって、体がうまーいこと調整してくれるから、気にせず糖質制限しても大丈夫ってことですね。
・・・はい、そうです。
私も小難しいことはあまり書きたくないのですが、糖質制限を勧めるにあたって、ケトーシスが怖くないと言うにあたって、なにかと理屈を求めてくる方(主に糖質制限を感情的に批判される方^^)が多いので書いてみました。読んだ反対派の人の科学的で理論的な意見も聴いてみたいなと思います。
はじめまして。
20年前に膵臓の腫瘍摘出手術で尾部切除し、その後三年で糖尿病となりました。
糖質制限を今年3月に知り始めてまだ4か月弱です。
4月にアシドーシスを経験しており、最近また同じような症状があるので心配なのですが
先生の考察がとても合っていると感じます。
私の場合Cペプチドは1.4~1.5なので少な目ですが出てはいます。
夜、寝ていると足が攣ることが頻繁です。何度も痛みに耐えながら攣った足に全体重をかけて伸ばします。そういう日にはたいてい血糖値が高め(200くらい)です。頻脈傾向にもなります。動悸がしたり脱力感が出始めるとかなりやばい感じです。
昨日は午前中に頻脈で不快感があり血糖値も空腹時182から192でなんとか血糖値を下げたくて運動をしました。3時間後には血糖値が138まで下がり一旦は安心したのですが、またその夜中にはいつもより足の攣り方が頻回で両足同時に攣ったりもして歩けないほどでした。
足に乳酸がたまってる感じで重くて硬くて腰も曲げられないほどでした。
このままでは救急車のお世話になることになってしまうと思いインスリンと糖質を少量ずつ摂りなんとか体がほぐれるようになったのです。
私は一般人ですのでなんの知識もないのですが 子供さんの病気のためにケトン食をしている方からの助言があっての事です。
足の攣り方のひどさ、アシドーシスになりそうな怖さ、同じことを繰り返したくないと思っているところに先生のブログを見つけました。
アシドーシスになりそうな時の予防策を教えていただけたら助かります、よろしくお願いします。
>yuunさん
コメントありがとうございます。
さて、膵臓の腫瘍摘出後の糖尿病発症ということですが、その場合はインスリンの絶対量が足りていないということになります。
>Cペプチドは1.4~1.5なので少な目ですが出てはいます。
ということですが、出ていないつもりで(そのインスリン分泌が適正なタイミングでの分泌なのかどうかがわかりませんし)きちんとインスリンを投与することが重要です。
この記事でもアシドーシス発生の条件を書いていますが、すべてインスリン量の不足が背景にあります。
アシドーシス予防の上でもっとも大事なのは
「インスリンが不足する状態に陥らない」
ことです。
yuunさんがこれまでどのようなインスリン投与をされてきたのかがわかりませんが、糖質制限を開始するにあたって極端な投与量の変更をされていないかがちょっと心配です。
持続型インスリンと速効型インスリンの両方を投与されていた場合、
1.持続型のインスリン投与は変更しないでください。
2.速効型のインスリン投与量の減量は主治医の意見に従って実施してください。
3.最終的に、yuunさんは糖質制限のそれぞれの食事内容でどの程度の血糖値の増減があるのかをつかんで、必要と考えられる量の速効型インスリンを使うことを躊躇しないでください。
それがアシドーシスの発症を防ぐためには最も重要です。
その基本の上で、
> アシドーシスになりそうな時の予防策を教えていただけたら助かります、よろしくお願いします。
ということでしたら、その「アシドーシスになりそうだと感じた」ときにはすでにpHは下がり始めている可能性がありますので
これも基本通りですが、まずは持続型インスリンの打ち忘れ、打ち損ねがないかを確認した上で
1.水分を十分に摂取する
2.ブドウ糖を少し摂取する
3.風邪を引いている、けがをしている、心理的な強いショックを受けた、などのストレスがかかっているときにはそれに対処する(病院などに行くということです)
で、お願いします。
1型糖尿病患者さんや膵臓の手術後の患者さんでは、もっとも大事なのは正しいタイミングでインスリンを打つことです。
ただし、糖質制限は食後高血糖を下げますので、速攻型インスリンの投与量を減らす効果は期待できます、これが最終的にはインスリン投与過多による合併症を低減します。
ということで糖質制限に取り組まれることは応援しますが、インスリンをいきなりやめたり極端に減らしたりしないでくださいね。
お返事ありがとうございます。
糖質制限することは応援してくださる。
ということは糖質制限自体が私に合わないということではないと思ってよいのですね。
糖質制限をし始めてから体調が湧くる鳴ることが多くなったので周囲から合わないからやめた方がいいのでは?と言われたりもするのです。
ですが自分としてはもう少し自分の体を見つめて体調を自分で管理できるようになりたいと思うので
1、水分の摂取
2.ブドウ糖を少し摂る
3.風邪などの時の対処
それと持続型インスリンを急にやめるとか、極端に減らさないように気をつけます!
ありがとうございます。今後も勉強させてくださいね
>yuunさん
> 糖質制限することは応援してくださる。 ということは糖質制限自体が私に合わないということではないと思ってよいのですね。
・・・そういう風に言質を取るけどよいかと言われるのであれば(;^ω^)、私は何も書けなくなります、あなたから全貌を聴いているわけでもなければ診察しているわけでもない。責任もって申せませんよ。私からの返信コメントに対してそのようなとらえ方をするのであれば、今後はあなたのコメントには返信できませんのでご了承ください。
> 糖質制限をし始めてから体調が湧くる鳴ることが多くなったので周囲から合わないからやめた方がいいのでは?と言われたりもするのです。
・・・私のブログでは「糖質制限が向いていない人の可能性」についていくつかの記事で言及しています。(100人に1人ぐらいは厳しい糖質制限は向かない可能性があると考えています。)
「糖質制限して具合が悪くなった場合にどんなことが原因であるかの可能性や対処法」についてもいくつかの記事で言及しています。
それらをよく読んで、該当しないか自己責任で判断し、対処もご検討ください。
よろしくお願いいたします。
糖尿病性ケトアシドーシス(DKA)が起こるトラブルとして、もう一つあります。
ご存じだと思いますが、SGLT2阻害薬です。既出でしたらごめんなさい。
インスリンの基礎分泌があったとしても、飢餓状態もしくはカロリー不足がある状態で、SGLT2阻害薬を使用すると、インスリンの分泌なしに、血糖値を下げるのでGLUT4が機能しません。すると筋肉細胞内に血糖は取り込まれないので、ますます細胞内飢餓状態になります。
SGLT2阻害薬の副作用で、正常血糖な糖尿病性ケトアシドーシスは、この飢餓状態やカロリー不足時にSGLT2阻害薬を使った場合だと考えられます。
>福田世一先生
コメントありがとうございます。
私のブログでも1型糖尿病患者さんがSGLT2阻害剤を使ってケトアシドーシスでバタバタ倒れているという話を2017年6月に患者さんから相談され、考察させていただいております。
1型糖尿病患者さんがSGLT2阻害剤を使う危険性について
http://xn--oqqx32i2ck.com/review/cat4/sglt2_1.html
SGLT2阻害剤内服でケトアシドーシスになるメカニズムの仮説
http://n--oqqx32i2ck.com/review/cat4/sglt2_2.html
おっしゃる通りに、SGLT2阻害剤の使い方に関しては注意が必要で、ネット経由などで安易に手に入れて使うべきではないと思います。
また、主治医がまだこの薬の価値と使い方をまったく理解していないケースが多いと思いますので、時間をかけて取り組んでいかなくてはならないと思います、その意味では厚生労働省が歯止めをかけたがるのもよく理解できます。
でも、一部の1型糖尿病患者さんが先走ってケトアシドーシスに苦しんでくださったおかげでようやく考察できたのも事実ですけれども。
カルピンチョ先生へ
はじめたおたよりします。私は60才台の内科医でメタボの患者さんを多数診療しています。
減量できない患者さんにどうしたら減量させられるのか悩んでいますが、糖質制限食に
解答があるのか、勉強しているところです。ところで、先生のブログを読ませていただきましたが
理解できないことがあります。以下に私なりに理解したことを書いてみます。
カルピンチョ先生によれば、DM性ケトアシードーシスではインスリンの絶対的な欠乏により
ブドウ糖の細胞内への取り込みができないので(細胞での利用ができないので)、代わりの
エネルギー源として肝細胞で脂肪酸よりケトン体の合成が亢進する。
ところでケトン体エンジンが回る(TCA回路で好気的に燃焼される)ためには僅かのブドウ糖が
必要であるが(ブドウ糖からピルビン酸、アセチルCoA、クエン酸をつくる)、筋肉細胞や
脂肪細胞はこれが準備できずにTCA回路を回すことができない。非常事態に陥った筋肉細胞
や脂肪細胞は蓄えてあったグリコーゲンを分解し、ブドウ糖に換えてエネルギーとして利用
することになる。TCA回路が回っていないので嫌気的解糖が進み乳酸が増加する。
ブドウ糖がないからTCA回路が回らないといっておきながら、乳酸が生成されるブドウ糖が
あるのは矛盾しませんか。
細胞の中にのみあって血中に測定することができない乳酸を仮定しなくても、高血糖と
絶対的なインスリン不足の結果、腎での酸を分泌する代償機序が破綻してケトアシドーシス
が出現する、と単純に考えることはできないでしょうか? 逆にいえば、糖質制限食における
ケトーシス(ケトアシドーシスでよいと思いますが)acidemia にならないのは、腎による代償
機序がうまく働いているためではないでしょうか
>きりんさん
この文章を書いたときの私の考えは補足させていただければこういうものです。()の中を書くべきだったでしょうか、わかりにくくはなりますが。
「(血中の)ブドウ糖の細胞内への取り込みができないので(細胞での利用ができないので)、代わりの
エネルギー源として肝細胞で脂肪酸よりケトン体の合成が亢進する。
ところでケトン体エンジンが回る(TCA回路で好気的に燃焼される)ためには(血中から)僅かのブドウ糖が(インスリン受容体からの刺激に伴ってGLUTを介して細胞内に取りこまれることが)必要であるが(ブドウ糖からピルビン酸、アセチルCoA、クエン酸をつくる)、筋肉細胞や脂肪細胞は(血中のブドウ糖をとりこめなくて)これが準備できずにTCA回路を回すことができない。
非常事態に陥った筋肉細胞や脂肪細胞は(細胞内に)蓄えてあったグリコーゲンを分解し、ブドウ糖に換えてエネルギーとして利用することになる。(しかしインスリン受容体からのシグナルなしに細胞内のグリコーゲンの分解で得られたブドウ糖だけでは)TCA回路が回っていないので嫌気的解糖が進み乳酸が増加する。」
「ブドウ糖がないからTCA回路が回らないといっておきながら、乳酸が生成されるブドウ糖が
あるのは矛盾しませんか。」
そうですね、そのように誤解を与えて申し訳ありません。もっと微細に論理的な矛盾がないように書くべきですね、失礼いたしました。
「細胞の中にのみあって血中に測定することができない乳酸を仮定しなくても、高血糖と 絶対的なインスリン不足の結果、腎での酸を分泌する代償機序が破綻してケトアシドーシス が出現する、と単純に考えることはできないでしょうか?」
・・・はい、最初の頃は私もそのように単純に考えていました。しかし、「絶対的なインスリン不足になると腎での酸を分泌する代償機序が破たんする」という論理をサポートするエビデンスを私は知らないのです、ご存じでしたら文献をぜひ教えてください。
なお、今現在は糖尿病性ケトアシドーシスをどう考えているかというと、ともかくインスリンが絶対的に不足したり、インスリン抵抗性が著しく上がっているにもかかわらず高血糖、あるいは脱水状態になるような状況さえ作り出さなければ予防できる、発症メカニズムはどうでもいいかなと思っております。(考えても現実的にはメリットがないので)